Une nouvelle technique montre avec une précision inédite le processus d’initiation de l’infection bactérienne
Selon l’Organisation mondiale de la santé, la résistance aux antimicrobiens figure parmi les 10 principales menaces auxquelles l'humanité se retrouve aujourd’hui confrontée, constituant un danger considérable tant pour la santé mondiale que pour la sécurité alimentaire. Cette résistance prend des proportions préoccupantes à travers le monde.
Pour trouver des solutions à la résistance aux antimicrobiens, il est essentiel de comprendre l'interaction entre les bactéries et les cellules humaines sur le site de l’infection. En effet, ces interactions sont fondamentales pour la conception de médicaments novateurs, qui pourront contribuer à la réduction de l’impact des souches résistantes en empêchant la survenue des infections.
Des chercheurs de l'Institut Laue Langevin (ILL) et du Centre de Recherches sur les Macromolécules Végétales (CERMAV) ont utilisé les neutrons pour analyser le processus de reconnaissance qui initie l'infection dans les cellules hôtes. Ils ont pour cela observé des récepteurs protéiques, les lectines, agents facilitateurs de ce processus pour une grande variété de micro-organismes, dont les virus et les bactéries.
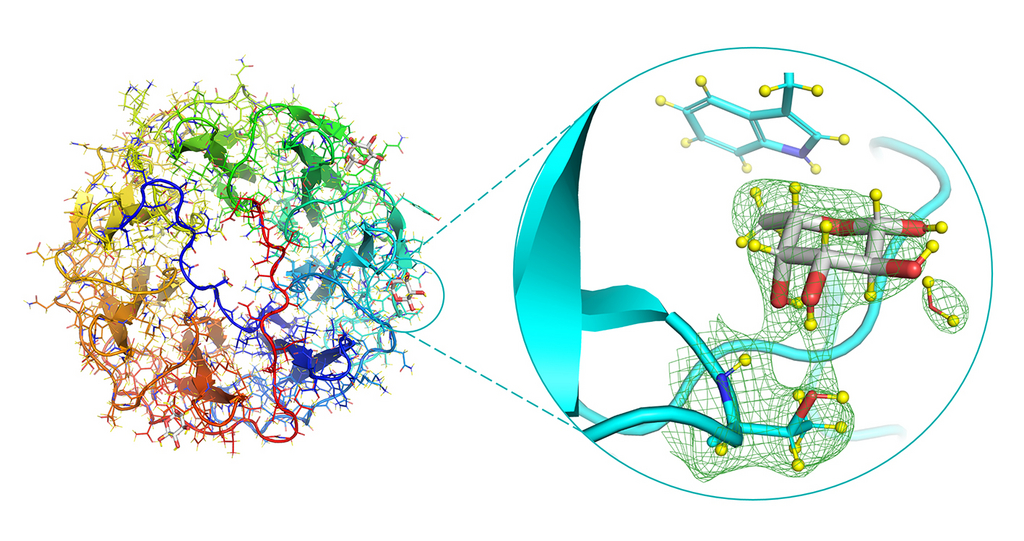
Structure neutronique du complexe PLL/fucose, et plan rapproché du site de liaison du fucose (à droite). La densité neutronique est représentée par le maillage vert.
Les lectines s’attachent aux sucres (glycanes) présents à la surface de la cellule hôte et déterminent les caractéristiques qui rendent ces minuscules organismes si dangereux : leur infectiosité, leur capacité d’adhésion, parfois même leur manière d’interagir avec d'autres microbes. Ce processus est facilité par la reconnaissance spécifique des lectines pour certains sucres parmi l’extraordinaire diversité des glycanes présents à la surface de la cellule. Après avoir déchiffré le « glycocode » grâce à leur récepteurs lectines, les bactéries peuvent prendre le contrôle des tissus. Des recherches ont démontré que l’infectiosité des bactéries diminue considérablement si celles-ci n’arrivent pas à déchiffrer et reconnaître les sucres.
Afin de mieux comprendre ce processus de reconnaissance spécifique, les scientifiques ont utilisé la cristallographie neutronique des protéines pour découvrir la structure atomique complète d'une lectine bactérienne en interaction avec le fucose (sucre simple constitutif de sucres plus complexes). Les neutrons sont un outil exceptionnellement efficace pour l’observation des liaisons hydrogène, et donc parfaitement adaptés à l’étude des interactions protéines-hydrates de carbone (protéine-sucre). En effet, les neutrons sont fortement diffusés par les noyaux des atomes d'hydrogène, phénomène qui peut être utilisé pour cartographier les liaisons à l'œuvre dans les interactions. C'est cette précision atomique exhaustive qui nous permettra d’affiner notre compréhension pour la conception rationnelle de molécules thérapeutiques.
Grâce à l’utilisation d’une nouvelle méthode, les chercheurs ont pu observer les interactions avec un niveau de précision inédit. En effet, la lectine et le sucre ont été perdeutérés in vivo. En utilisant des bactéries modifiées pour élaborer le sucre étudié, le fucose, les atomes d'hydrogène ont été remplacés par des atomes de deutérium, afin de permettre un plus grand contraste et ainsi une meilleure précision expérimentale. Cette méthode de préparation n'est pas encore couramment utilisée. Or, elle pourrait remarquablement accroître la visibilité des processus de liaison, permettant une modélisation efficace de l'interaction bactérie-sucre dans d'autres modèles pour le développement de médicaments à l’avenir.
En plus de l’amélioration de la modélisation des interactions protéine-sucre, nos recherches permettront aux scientifiques de découvrir des approches alternatives pour empêcher les bactéries de se lier aux cellules humaines, autrement dit de développer des thérapies par inhibition de l'adhésion bactérienne. C’est une piste particulièrement prometteuse, car elle n’applique pas de pression de sélection sur la survie des bactéries et n’accentue donc pas la résistance aux antibiotiques.
« Nous pourrions étudier des bactéries beaucoup plus pathogènes pour mieux comprendre cette interaction. Les protéines qui se lient aux sucres sont une cible idéale pour la cristallographie neutronique, car de nombreuses interactions avec le sucre impliquent des atomes d'hydrogène. Nous avons pu caractériser ici, avec un niveau de précision inédit, un réseau exhaustif des liaisons hydrogène entre la lectine bactérienne et le fucose ». selon Lukáš Gajdoš, doctorant, Institut Laue-Langevin.
- Production of perdeuterated fucose from glyco-engineered bacteria (2021) : DOI: 10.1093/glycob/cwaa059
- Visualization of hydrogen atoms in a perdeuterated lectin-fucose complex reveals key details of protein-carbohydrate interactions (2021) : DOI: doi.org/10.1016/j.str.2021.03.003
ILL Instrument: LADI-III, which delivers a high flux of neutrons and only requires a sample size of 0.05-0.1 mm3 in order to get results. The samples were prepared using the Deuteration Laboratory (D-Lab) platform in the ILL's Life Sciences group.
Contact:.” Lukáš Gajdoš (ILL)
