30 ans plus tard: la transition dynamique réétudiée sous pression
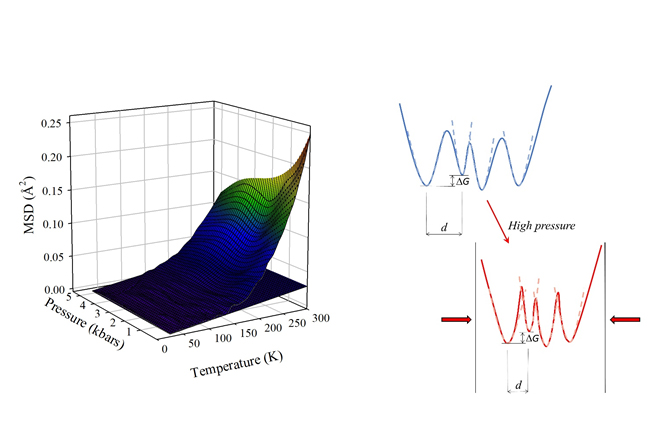
Mean Square Displacements (MSD) obtained from the analysis in terms of a two-state model and schematic representation of the effects of pressure on the protein energy landscape
La dynamique des protéines est caractérisée par des fluctuations entre différents sous-états conformationnels, c. à d. les différents minima du paysage énergétique. A des températures au-dessus de 200 K, ces fluctuations entrainent une nette augmentation de toutes les propriétés dynamiques en fonction de la température. Ce phénomène est connu comme transition dynamique des protéines. Malgré des études intensives, peu est connu de l’effet de la pression sur ces processus, car la pression est généralement étudiée à température ambiante. La diffusion neutronique est une technique idéale pour la recherche de ces phénomènes. En particulier, la diffusion élastique incohérente de neutrons donne accès aux déplacements carré moyens (MSD) des hydrogènes dans les protéines. Comme les atomes d’hydrogène représentent environ la moitié des atomes dans une protéine et sont à peu près régulièrement distribués dans la molécule, cette technique permet une vue globale des mouvements internes.
Les effets de la pression sur le paysage énergétique des protéines et sur leurs propriétés dynamiques internes sont le sujet d’une étude récente publiée dans Scientific Reports. Cette étude est basée sur une collaboration entre des chercheurs de l’ILL et de l’Université Grenoble Alpes, de l’institut de biophysique du centre italien de recherche nationale (IBF-CNR, Palermo, Italie) et du département de physique et de chimie de l’Université de Palerme (Italie). Dans ce travail, la dynamique de la myoglobine a été étudiée dans des larges domaines de température et pression. Les expériences ont été réalisées sur le spectromètre à rétrodiffusion IN13 de l’ILL. Pour cela, un échantillon très visqueux d’un mélange per-deutéré glycérol-protéine-eau a été utilisé, qui est bien approprié pour la transmission de la pression à des températures cryogéniques et pour une bonne détection des mouvements internes de la protéine. Les résultats montrent que la haute pression réduit les mouvements de la protéine, mais ne change pas la température du début de la transition dynamique, ce qui indique que les différences en énergie et les barrières entre sous-états conformationnels ne sont pas modifiés par la pression. Au contraire, la réduction observée à haute pression des mouvements internes de la protéine doit être attribuée à une réduction correspondante dans les différences moyennes structurales entre les sous-états conformationnels accessibles, ce qui veut dire à une augmentation de la rugosité effective du paysage de l’énergie libre du système.
Comme les propriétés dynamiques des protéines sont couplées sur des décades en temps et autosimilaires, nos résultats peuvent aider à construire un scenario unique des effets de la pression sur la dynamique protéique. En effet, un paysage énergétique plus rugueux peut avoir une grande influence sur la dynamique de la sub-nanoseconde des protéines, comme dans notre étude, mais il peut aussi impacter les mouvements à des échelles de temps beaucoup plus longues, jusqu’à celles nécessaires pour le fonctionnement des protéines ou même des processus comme le repliement ou le dépliement. Ce travail a été publié dans Scientific Reports
Contact: Judith Peters (UGA, LiPhy et ILL)

Fig : Les MSD obtenus grâce à une analyse avec un modèle à deux états et une représentation schématique des effets de la pression sur le paysage énergétique d’une protéine
Contact:Judith Peters (UGA, LiPhy and ILL)
